Chirurgische Forschung
Wissenschaftlicher Erkenntnisgewinn durch kliniknahe Grundlagenforschung: Entwicklungsmöglichkeit neuer Therapieansätze für Patienten
Wir begrüßen Sie herzlich auf der Forschungswebseite unserer Klinik. Unsere Forschungsschwerpunkte liegen in klinischen Studien und in der Aufklärung der molekularen Mechanismen der Krankheitsentstehung in den Bereichen Hepato-Pankreato-Biliäre Erkrankungen (d.h. vor allem Pankreas und Leber), Endokrine Erkrankungen (Schilddrüse, Schilddrüsenkarzinome, neuroendokrine Tumore) und Gefäßerkrankungen (Atherosklerose). Durch diese Forschungsarbeiten möchten wir neue und/ oder verbesserte Therapieansätze und Konzepte für unsere Patienten finden. Wir engagieren uns natürlich auch für die wissenschaftliche Ausbildung unserer Studentinnen/ Studenten und jungen Wissenschaftlerinnen/ Wissenschaftler. Wer Interesse an unseren Forschungsthemen hat, insbesondere auch an der Möglichkeit zu promovieren, kann sich gerne über das Sekretariat der chirurgischen Klinik weiter informieren.
(0345 557 2314 oder E-Mail).
Neben unseren grundlagenwissenschaftlichen Arbeiten führen wir auch klinische Studien, systematische Übersichtsarbeiten und Meta-Analysen im Sinne einer evidenzbasierten Medizin/ Chirurgie durch.
In Zusammenarbeit mit anderen Zentren untersuchen mehrere Studien, inwieweit verschiedene Therapieverfahren (Chirurgie, Chemotherapie, Strahlentherapie) und deren Kombination eine möglichst effektive Behandlung von Tumoren von Speiseröhre, Magen oder Bauchspeicheldrüse darstellen. Eine andere Studie betrachtet die Lebensqualität von Patienten mit Tumoren der Verdauungsorgane, die operiert wurden. Weitere Analysen befassen sich mit Möglichkeiten zur Vorhersage und Vermeidung von Komplikationen nach Operationen an den Verdauungsorganen.
(Literatur z.B. Rebelo et al., How to Reduce Delayed Gastric Emptying After Pancreatoduodenectomy: A Systematic Literature Review and Meta-Analysis. Ann Surg Open. 2024; Rebelo et al. Acute and chronic mesenteric ischemia: single center analysis of open, endovascular, and hybrid surgery. BMC Surg. 2022; Rebelo et al. Systematic review and meta-analysis of contemporary pancreas surgery with arterial resection. Langenbecks Arch Surg. 2020)
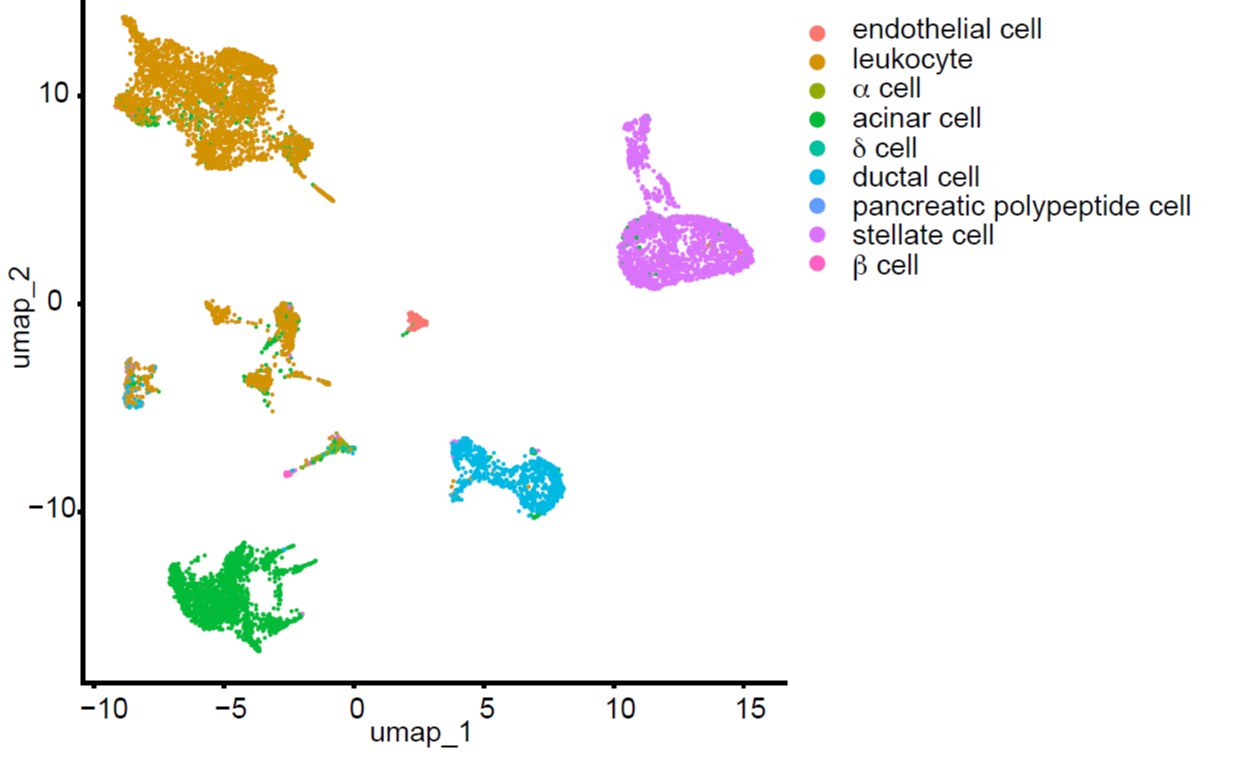
Die Tumormikroumwelt spielt eine entscheidende Rolle in der Entstehung, dem Fortschreiten und der Therapie von Krebs. Eine zentrale Komponente ist die entzündliche Reaktion des Körpers, die normalerweise dazu dient, beschädigtes Gewebe zu reparieren und Fremdkörper zu entfernen. Chronische Entzündungen hingegen können zu anhaltenden Reparaturprozessen führen, die das Erbgut schädigen und so die Tumorentstehung fördern. Tumorzellen wiederum setzen Faktoren frei, die Entzündungsprozesse aufrechterhalten und so einen Teufelskreis schaffen, der das Tumorwachstum weiter begünstigt. Eine wesentliche Rolle in diesem Prozess spielen stromale Zellen, insbesondere die sogenannten "Cancer-Associated Fibroblasts" (CAFs). Diese Fibroblasten sind äußerst heterogen und erfüllen eine Vielzahl von Funktionen innerhalb der Tumorumgebung. Unsere Forschung hat gezeigt, dass verschiedene Subtypen von CAFs spezifische Rollen übernehmen können, von der Förderung des Tumorwachstums über die Modulation des Immunsystems bis hin zur Unterstützung der Metastasierung. Diese Heterogenität der CAFs bietet neue Ansatzpunkte, um gezielte Therapien zu entwickeln, die spezifische Subpopulationen angreifen und so die Tumorprogression hemmen.
Ein weiterer Schwerpunkt unserer Arbeit liegt auf der Untersuchung des immunsuppressiven Tumormikromilieus. Tumore schaffen eine Umgebung, die Immunzellen wie T-Zellen in ihrer Funktion hemmt, während sie die Aktivität regulatorischer Zellen, wie Tregs oder myeloider Suppressorzellen, fördern. CAFs tragen wesentlich zu diesem immunsuppressiven Milieu bei, indem sie Zytokine, Chemokine und andere immunmodulatorische Faktoren freisetzen. Dies erschwert nicht nur die körpereigene Immunabwehr, sondern stellt auch eine Herausforderung für die Wirksamkeit von Immuntherapien dar.
Ein dritter Aspekt unserer Forschung beschäftigt sich mit der Rolle von CAFs in den frühen Stadien der Pankreaskarzinogenese. Hier zeigen unsere Studien, dass CAFs bereits vor der Tumorbildung aktiv werden und durch die Sekretion bestimmter Signalstoffe präkanzeröse Veränderungen im umliegenden Gewebe fördern. Diese Erkenntnisse unterstreichen die Bedeutung der stromalen Mikroumwelt nicht nur im fortgeschrittenen Krebsstadium, sondern auch in der Initiierung der Tumorbildung.
Das Zusammenspiel von Entzündungszellen, CAFs und Krebszellen ist daher ein vielversprechendes Forschungsfeld, das sowohl zu einem besseren Verständnis der Tumorbiologie als auch zur Entwicklung neuer Diagnose- und Therapiemöglichkeiten beitragen kann.
(Literatur z.B. Ohri et al. Gene expression dynamics in fibroblasts during early-stage murine pancreatic carcinogenesis. iScience. 2024; Zourelidis et al. Distance-depending transcriptome changes of pancreatic stellate cells in paracrine pancreatic ductal adenocarcinoma co-culture models. Sci Rep. 2024; Chen et al. Periostin is associated with prognosis and immune cell infiltration in pancreatic adenocarcinoma based on integrated bioinformatics analysis. Cancer Rep (Hoboken); Sunami et al. Single Cell Analysis of Cultivated Fibroblasts from Chronic Pancreatitis and Pancreatic Cancer Patients. Cells. 2022; Böker et al. Analysis of genomic alterations in cancer associated human pancreatic stellate cells. Sci Rep. 2022)
Metabolismus oder Stoffwechsel ist die Grundlage aller lebenswichtigen Vorgänge in unserem Körper. Die Bestandteile der Nährstoffe (z.B. Kohlenhydrate, Fette, und Eiweiße) werden durch ein reguliertes Stoffwechselsystem abgebaut, umgebaut oder aufgebaut. Das Stoffwechselsystem stellt die Energie für alle biologischen Aufgaben unseres Körpers zur Verfügung. Der Stoffwechsel wird durch zahlreiche Faktoren beeinflusst, unter anderem auch durch Sauerstoff. Die Krebszellen zeigen einen besonderen Stoffwechsel, da sie eine erhörte Energieversorgung für schnelleres Wachstum, auch unter Bedienung des Sauerstoffmangels, benötigen. Durch neue Gefäßbildung oder eine Veränderung der Expression des Faktors, der u.a. die Gefäßneubildung kontrolliert, können Krebszellen mehr Energie zum Wachsen bekommen. Die Identifizierung und Aufklärung von Stoffwechsel-Regulatoren, nicht nur in Krebszellen, sondern auch in Stromazellen (insbesondere Cancer-associated fibroblasts) ist wichtig, um potenziell neue Therapiemöglichkeiten gegen den Krebs finden.
(Literatur z.B. Rebelo et al. Cholesterol Metabolism in Pancreatic Cancer. Cancers (Basel). 2023; Sunami et al. Lipid Droplet-Associated Factors, PNPLA3, TM6SF2, and HSD17B Proteins in Hepatopancreatobiliary Cancer. Cancers (Basel). 2021; Bai et al. Identification of prognostic lipid droplet-associated genes in pancreatic cancer patients via bioinformatics analysis. Lipids Health Dis. 2021)
Europäischer Fonds für regionale Entwicklung (EFRE)
Projektförderung seit 2025 PI: Prof. Dr. med. Jörg Kleeff
Deutsche Forschungsgemeinschaft (DFG)
„Die Rolle von genetischen Varianten in tumorassoziierten Fibroblasten bei Magen-Darm-Krebs“ Projektförderung seit 2024. PI: Dr. Yoshiaki Sunami
Gerrit Meyer & Eka Meyer-Lausch-Stiftung
„Analysen des humanen Mikrobioms zur Identifikation von Risikopatientinnen und –patienten für postoperative infektiöse Komplikationen“ Projektförderung seit 2024. PI: Prof. Dr. med. Jörg Kleeff, PD Dr. med. Artur Rebelo
Advanced clinician scientist der Martin-Luther-Universität (ACS)
Projektförderung seit 2023. PI: PD Dr. med. Artur Rebelo
Deutsche Forschungsgemeinschaft (DFG)
GRK 2751 – Entzündliche Einflüsse als Modulation der frühen Pankreaskarzinogenese (INCUPANC) „Projekt B3: Einfluss der Fibroblastenaktivierung auf die frühe Pankreaskarzinogenese“ Projektförderung seit 2022. PI: Prof. Dr. med. Jörg Kleeff zusammen mit Dr. Markus Glaß
Ohri N, Häußler J, Javakhishvili N, Vieweg D, Zourelidis A, Trojanowicz B, Haemmerle M, Irene Esposito I, Glaß M, Sunami Y, Kleeff J. Gene expression dynamics in fibroblasts during early-stage murine pancreatic carcinogenesis. iScience. 2024 online Dec 10; 111572.
Zheng H, Yang X, Huang N, Yuan S, Li J, Liu X, Jiang Q, Wu S, Ju Y, Kleeff J, Yin X, Liao Q, Liu Q, Zhao Y. Chimeric antigen receptor macrophages targeting c-MET(CAR-M-c-MET) inhibit pancreatic cancer progression and improve cytotoxic chemotherapeutic efficacy. Mol Cancer. 2024 Dec 6;23(1):270. doi: 10.1186/s12943-024-02184-8.PMID: 39643883
Zhang R, Peng J, Zhang Y, Zheng K, Chen Y, Liu L, Li T, Liu J, Li Y, Yang S, Wang M, Cui M, Zhang X, Gao J, Kleeff J, Liao Q, Liu Q. Pancreatic cancer cell-derived migrasomes promote cancer progression by fostering an immunosuppressive tumor microenvironment. Cancer Lett. 2024 Nov 28;605:217289. doi: 10.1016/j.canlet.2024.217289. Epub 2024 Oct 9. PMID: 39389157
Rebelo A, Kresse R, Sunami Y, Ronellenfitsch U, Kleeff J, Klose J. How to Reduce Delayed Gastric Emptying After Pancreatoduodenectomy: A Systematic Literature Review and Meta-Analysis. Ann Surg Open. 2024 Jun 28;5(3):e458. doi: 10.1097/AS9.0000000000000458. eCollection 2024 Sep.PMID: 39310336
STARSurg Collaborative; EuroSurg Collaborative. Association between multimorbidity and postoperative mortality in patients undergoing major surgery: a prospective study in 29 countries across Europe. Anaesthesia. 2024 Sep;79(9):945-956. doi: 10.1111/anae.16324. Epub 2024 May 27. PMID: 39101671
Zourelidis A, Trojanowicz B, Sunami Y, Hause G, Vieweg D, Kleeff J. Distance-depending transcriptome changes of pancreatic stellate cells in paracrine pancreatic ductal adenocarcinoma co-culture models. Sci Rep. 2024 Aug 4;14(1):18030. doi: 10.1038/s41598-024-68148-6. PMID: 39098880
STARSurg Collaborative; EuroSurg Collaborative. Impact of postoperative cardiovascular complications on 30-day mortality after major abdominal surgery: an international prospective cohort study. Anaesthesia. 2024 Jul;79(7):715-724. doi: 10.1111/anae.16220. Epub 2024 Feb 2. PMID: 38303634
Chen Y, Kleeff J, Sunami Y. Pancreatic cancer cell- and cancer-associated fibroblast-derived exosomes in disease progression, metastasis, and therapy. Discov Oncol. 2024 Jul 2;15(1):253. doi: 10.1007/s12672-024-01111-z. PMID: 38954230
Zhou Q, Pichlmeier S, Denz AM, Schreiner N, Straub T, Benitz S, Wolff J, Fahr L, Del Socorro Escobar Lopez M, Kleeff J, Mayerle J, Mahajan UM, Regel I. Altered histone acetylation patterns in pancreatic cancer cell lines induce subtype‑specific transcriptomic and phenotypical changes. Int J Oncol. 2024 Mar;64(3):26. doi: 10.3892/ijo.2024.5614. Epub 2024 Jan 19. PMID: 38240084
Chen Y, Zhang F, Zhang B, Trojanowicz B, Hämmerle M, Kleeff J, Sunami Y. Periostin is associated with prognosis and immune cell infiltration in pancreatic adenocarcinoma based on integrated bioinformatics analysis. Cancer Rep (Hoboken). 2024 Feb;7(2):e1990. doi: 10.1002/cnr2.1990. PMID: 38389400
Liu Q, Li J, Zheng H, Yang S, Hua Y, Huang N, Kleeff J, Liao Q, Wu W. Adoptive cellular immunotherapy for solid neoplasms beyond CAR-T. Mol Cancer. 2023 Feb 7;22(1):28. doi: 10.1186/s12943-023-01735-9. PMID: 36750830
Hoffmann-Wieker CM, Rebelo A, Moll M, Ronellenfitsch U, Rengier F, Erhart P, Böckler D, Ukkat J. Association of Tumor Volumetry with Postoperative Outcomes for Cervical Paraganglioma. Diagnostics (Basel). 2023 Feb 15;13(4):744. doi: 10.3390/diagnostics13040744. PMID: 36832232
Rebelo A, Kleeff J, Sunami Y. Cholesterol Metabolism in Pancreatic Cancer. Cancers (Basel). 2023 Oct 27;15(21):5177. doi: 10.3390/cancers15215177. PMID: 37958351
Hoffmann-Wieker CM, Ronellenfitsch U, Rebelo A, Görg N, Schwarzer G, Ballotta E, Gouëffic Y, Böckler D. Open Surgical Thrombendarterectomy Versus Endovascular Treatment in Occlusive Processes of the Femoral Artery Bifurcation. Dtsch Arztebl Int. 2022 Nov 25;119(47):803-809. doi: 10.3238/arztebl.m2022.0331.PMID: 36424715
Mehdorn AS, Gemoll T, Busch H, Kern K, Beckinger S, Daunke T, Kahlert C, Uzunoglu FG, Hendricks A, Buertin F, Wittel UA, Sunami Y, Röcken C, Becker T, Sebens S. Biomarkers in Liquid Biopsies for Prediction of Early Liver Metastases in Pancreatic Cancer. Cancers (Basel). 2022 Sep 22;14(19):4605. doi: 10.3390/cancers14194605. PMID: 36230528
Sunami Y, Chen Y, Trojanowicz B, Sommerer M, Hämmerle M, Eils R, Kleeff J. Single Cell Analysis of Cultivated Fibroblasts from Chronic Pancreatitis and Pancreatic Cancer Patients. Cells. 2022 Aug 19;11(16):2583. doi: 10.3390/cells11162583. PMID: 36010660
Böker V, Häußler J, Baumann J, Sunami Y, Trojanowicz B, Harwardt B, Hammje K, von Auw N, Erkan M, Krohn K, Kleeff J. Analysis of genomic alterations in cancer associated human pancreatic stellate cells. Sci Rep. 2022 Aug 8;12(1):13532. doi: 10.1038/s41598-022-17748-1. PMID: 35941161
Leinenkugel G, Kong B, Raulefs S, Miller K, Roth S, Jiang H, Istvánffy R, Heikenwälder H, Maeritz N, Regel I, Abiatari I, Kleeff J, Michalski CW, Rieder S. Sca-1 is a marker for cell plasticity in murine pancreatic epithelial cells and induced by IFN-β in vitro. Pancreatology. 2022 Mar;22(2):294-303. doi: 10.1016/j.pan.2022.01.006. Epub 2022 Jan 13. PMID: 35120820
Rebelo A, Mammadov M, Partsakhashvili J, Sekulla C, Ronellenfitsch U, Kleeff J, John E, Ukkat J. Acute and chronic mesenteric ischemia: single center analysis of open, endovascular, and hybrid surgery. BMC Surg. 2022 Feb 13;22(1):56. doi: 10.1186/s12893-022-01511-4. PMID: 35152898
Sunami Y, Häußler J, Zourelidis A, Kleeff J. Cancer-Associated Fibroblasts and Tumor Cells in Pancreatic Cancer Microenvironment and Metastasis: Paracrine Regulators, Reciprocation and Exosomes. Cancers (Basel). 2022 Jan 31;14(3):744. doi: 10.3390/cancers14030744. PMID: 35159011
Ukkat J, Rebelo A, Trojanowicz B. Angiogenetic transcriptional profiling reveals potential targets modulated in blood of patients with cardiovascular disorders. Vascular. 2023 Feb;31(1):152-162. doi: 10.1177/17085381211052379. Epub 2021 Nov 24. PMID: 34816786
Zhang Z, Li H, Deng Y, Schuck K, Raulefs S, Maeritz N, Yu Y, Hechler T, Pahl A, Fernández-Sáiz V, Wan Y, Wang G, Engleitner T, Öllinger R, Rad R, Reichert M, Diakopoulos KN, Weber V, Li J, Shen S, Zou X, Kleeff J, Mihaljevic A, Michalski CW, Algül H, Friess H, Kong B. AGR2-Dependent Nuclear Import of RNA Polymerase II Constitutes a Specific Target of Pancreatic Ductal Adenocarcinoma in the Context of Wild-Type p53. Gastroenterology. 2021 Nov;161(5):1601-1614.e23. doi: 10.1053/j.gastro.2021.07.030. Epub 2021 Jul 23. PMID: 34303658
Sunami Y, Rebelo A, Kleeff J. Lipid Droplet-Associated Factors, PNPLA3, TM6SF2, and HSD17B Proteins in Hepatopancreatobiliary Cancer. Cancers (Basel). 2021 Aug 31;13(17):4391. doi: 10.3390/cancers13174391. PMID: 34503201
Bai R, Rebelo A, Kleeff J, Sunami Y. Identification of prognostic lipid droplet-associated genes in pancreatic cancer patients via bioinformatics analysis. Lipids Health Dis. 2021 Jun 2;20(1):58. doi: 10.1186/s12944-021-01476-y. PMID: 34078402
Ukkat J, Hoang-Vu C, Trojanowicz B, Rebelo A. Osteocalcin, Osteopontin and RUNX2 Expression in Patients' Leucocytes with Arteriosclerosis. Diseases. 2021 Mar 12;9(1):19. doi: 10.3390/diseases9010019. PMID: 33809272
Sunami Y, Böker V, Kleeff J. Targeting and Reprograming Cancer-Associated Fibroblasts and the Tumor Microenvironment in Pancreatic Cancer. Cancers (Basel). 2021 Feb 9;13(4):697. doi: 10.3390/cancers13040697. PMID: 33572223
López de Maturana E, Rodríguez JA, Alonso L, Lao O, Molina-Montes E, Martín-Antoniano IA, Gómez-Rubio P, Lawlor R, Carrato A, Hidalgo M, Iglesias M, Molero X, Löhr M, Michalski C, Perea J, O'Rorke M, Barberà VM, Tardón A, Farré A, Muñoz-Bellvís L, Crnogorac-Jurcevic T, Domínguez-Muñoz E, Gress T, Greenhalf W, Sharp L, Arnes L, Cecchini L, Balsells J, Costello E, Ilzarbe L, Kleeff J, Kong B, Márquez M, Mora J, O'Driscoll D, Scarpa A, Ye W, Yu J; PanGenEU Investigators; García-Closas M, Kogevinas M, Rothman N, Silverman DT; SBC/EPICURO Investigators; Albanes D, Arslan AA, Beane-Freeman L, Bracci PM, Brennan P, Bueno-de-Mesquita B, Buring J, Canzian F, Du M, Gallinger S, Gaziano JM, Goodman PJ, Gunter M, LeMarchand L, Li D, Neale RE, Peters U, Petersen GM, Risch HA, Sánchez MJ, Shu XO, Thornquist MD, Visvanathan K, Zheng W, Chanock SJ, Easton D, Wolpin BM, Stolzenberg-Solomon RZ, Klein AP, Amundadottir LT, Marti-Renom MA, Real FX, Malats N. A multilayered post-GWAS assessment on genetic susceptibility to pancreatic cancer. Genome Med. 2021 Feb 1;13(1):15. doi: 10.1186/s13073-020-00816-4. PMID: 33517887
Zhao Y, Schoeps B, Yao D, Zhang Z, Schuck K, Tissen V, Jäger C, Schlitter AM, van der Kammen R, Ludwig C, D'Haese JG, Raulefs S, Maeritz N, Shen S, Zou X, Krüger A, Kleeff J, Michalski CW, Friess H, Innocenti M, Kong B. mTORC1 and mTORC2 Converge on the Arp2/3 Complex to Promote KrasG12D-Induced Acinar-to-Ductal Metaplasia and Early Pancreatic Carcinogenesis. Gastroenterology. 2021 Apr;160(5):1755-1770.e17. doi: 10.1053/j.gastro.2020.12.061. Epub 2021 Jan 1. PMID: 33388318
Sunami Y, Häußler J, Kleeff J. Cellular Heterogeneity of Pancreatic Stellate Cells, Mesenchymal Stem Cells, and Cancer-Associated Fibroblasts in Pancreatic Cancer. Cancers (Basel). 2020 Dec 15;12(12):3770. doi: 10.3390/cancers12123770. PMID: 33333727
Fahr L, Sunami Y, Maeritz N, Steiger K, Grünewald TGP, Gericke M, Kong B, Raulefs S, Mayerle J, Michalski CW, Regel I, Kleeff J. Expression of the EWSR1-FLI1 fusion oncogene in pancreas cells drives pancreatic atrophy and lipomatosis. Pancreatology. 2020 Dec;20(8):1673-1681. doi: 10.1016/j.pan.2020.10.033. Epub 2020 Oct 10. PMID: 33051146
Rebelo A, Büdeyri I, Heckler M, Partsakhashvili J, Ukkat J, Ronellenfitsch U, Michalski CW, Kleeff J. Systematic review and meta-analysis of contemporary pancreas surgery with arterial resection. Langenbecks Arch Surg. 2020 Nov;405(7):903-919. doi: 10.1007/s00423-020-01972-2. Epub 2020 Sep 7. PMID: 32894339
Sunami Y. NASH, Fibrosis and Hepatocellular Carcinoma: Lipid Synthesis and Glutamine/Acetate Signaling. Int J Mol Sci. 2020 Sep 16;21(18):6799. doi: 10.3390/ijms21186799. PMID: 32947972
Liu Q, Wu H, Li Y, Zhang R, Kleeff J, Zhang X, Cui M, Liu J, Li T, Gao J, Pan B, Wu W, Wang W, Zhou L, Guo J, Dai M, Zhang T, Liao Q, Lu Z, Zhao Y. Combined blockade of TGf-β1 and GM-CSF improves chemotherapeutic effects for pancreatic cancer by modulating tumor microenvironment. Cancer Immunol Immunother. 2020 Aug;69(8):1477-1492. doi: 10.1007/s00262-020-02542-7. Epub 2020 Apr 13. PMID: 32285172
Lu M, Hartmann D, Braren R, Gupta A, Wang B, Wang Y, Mogler C, Cheng Z, Wirth T, Friess H, Kleeff J, Hüser N, Sunami Y. Oncogenic Akt-FOXO3 loop favors tumor-promoting modes and enhances oxidative damage-associated hepatocellular carcinogenesis. BMC Cancer. 2019 Sep 5;19(1):887. doi: 10.1186/s12885-019-6110-6. PMID: 31488102
Benitz S, Straub T, Mahajan UM, Mutter J, Czemmel S, Unruh T, Wingerath B, Deubler S, Fahr L, Cheng T, Nahnsen S, Bruns P, Kong B, Raulefs S, Ceyhan GO, Mayerle J, Steiger K, Esposito I, Kleeff J, Michalski CW, Regel I. Ring1b-dependent epigenetic remodelling is an essential prerequisite for pancreatic carcinogenesis. Gut. 2019 Nov;68(11):2007-2018. doi: 10.1136/gutjnl-2018-317208. Epub 2019 Apr 6. PMID: 30954952
Neuzillet C, Tijeras-Raballand A, Ragulan C, Cros J, Patil Y, Martinet M, Erkan M, Kleeff J, Wilson J, Apte M, Tosolini M, Wilson AS, Delvecchio FR, Bousquet C, Paradis V, Hammel P, Sadanandam A, Kocher HM. Inter- and intra-tumoural heterogeneity in cancer-associated fibroblasts of human pancreatic ductal adenocarcinoma. J Pathol. 2019 May;248(1):51-65. doi: 10.1002/path.5224. Epub 2019 Feb 22. PMID: 30575030
Cheng T, Zhang Z, Jian Z, Raulefs S, Schlitter AM, Steiger K, Maeritz N, Zhao Y, Shen S, Zou X, Ceyhan GO, Friess H, Kleeff J, Michalski CW, Kong B. Ductal obstruction promotes formation of preneoplastic lesions from the pancreatic ductal compartment. Int J Cancer. 2019 May 15;144(10):2529-2538. doi: 10.1002/ijc.31981. Epub 2018 Dec 12. PMID: 30412288
Sunami Y, Kleeff J. Immunotherapy of pancreatic cancer. Prog Mol Biol Transl Sci. 2019;164:189-216. doi: 10.1016/bs.pmbts.2019.03.006. Epub 2019 Mar 22. PMID: 31383405
Regel I, Raulefs S, Benitz S, Mihaljevic C, Rieder S, Leinenkugel G, Steiger K, Schlitter AM, Esposito I, Mayerle J, Kong B, Kleeff J, Michalski CW. Loss of TLR3 and its downstream signaling accelerates acinar cell damage in the acute phase of pancreatitis. Pancreatology. 2019 Jan;19(1):149-157. doi: 10.1016/j.pan.2018.12.005. Epub 2018 Dec 15. PMID: 30583980
Leiter

PD Dr. Bogusz Trojanowicz
Wissenschaftlicher Koordinator und AG Leiter
Dr. Yoshiaki Sunami
Wissenschaftlicher Mitarbeiter
Forschungslabor
Wissenschaftliche Mitarbeiterinnen/Mitarbeiter

Nino Javakhishvili
GastwissenschaftlerinGina Goldschmidt
Wissenschaftliche Mitarbeiterin, PhD Studentin
Doktorandinnen/Doktoranden
Jenny Baumann
Medizin DoktorandinCeline Bressau
Medizin DoktorandinYijun Chen
Medizin DoktorandJulia Förster
Medizin Doktorandin
Justus Handke
Medizin DoktorandAntje Treppe
Medizin DoktorandinLaura Oelschlägel
Medizin DoktorandinYuhang Shen
Medizin DoktorandNathalie Wagner
Medizin DoktorandinCedric Weiser
Medizin DoktorandXing Wu
Medizin DoktorandBolin Zhang
Medizin Doktorand